Parceria GIA-ATGC
No dia 09 de fevereiro de 2021 foi finalmente assinado o Termo de Compartilhamento estabelecido entre a UFPR, através de...
Por Camila Tavares
Projeções populacionais globais preveem a expansão da população humana da estimativa atual de 7 bilhões para entre 8,8 e 9,1 bilhões em 2050 (Fischer et al., 2009; Anderson, 2010). Nas três décadas entre 1970 e 2000, ocorreram aumentos significativos no consumo global de alimentos per capita, aumentando quase 400 kcal por pessoa por dia. Curiosamente, não apenas o consumo de calorias foi alterado, mas a composição da dieta também mudou em várias regiões. Por exemplo, na China, o aumento do consumo de óleos vegetais (680%), carne (349%) e açúcar (305%) acompanhou um declínio no consumo de leguminosas, raízes e tubérculos no período de 1963 a 2003 (Kearney, 2010). A mudança na demanda por alimentos associada a alterações demográficas leva a perguntas sobre o futuro suprimento de alimentos e a chamada “segurança alimentar” global. A segurança alimentar é definida como o cenário em que “todas as pessoas têm acesso físico, social e econômico a alimentos suficientes, seguros e nutritivos para satisfazer suas necessidades e preferências alimentares para uma vida ativa e saudável” (FSN Forum 2007; http://km.fao.org/fsn/).
Em termos de proteína animal, os sistemas de produção de gado ocupam cerca de 30% da área de superfície livre de gelo do mundo (Steinfeld et al., 2006), valem cerca de 1,4 trilhões de dólares e empregam mais de 1,3 bilhões de pessoas no mundo (Thornton, 2010). A produção global de proteína de animais aquáticos inclui a aquicultura marinha e de água doce. A aquicultura cresceu mais rapidamente do que qualquer outro setor produtor de alimentos durante os últimos 50 anos, a produção global aquícola foi de 110,2 milhões de toneladas, estimando-se um valor comercial de primeira venda em cerca de 243 milhões de dólares em 2016 (FAO 2018). No Brasil, por exemplo, a aquicultura brasileira apresentou crescimento de 123% entre 2005 e 2015, passando de 257 mil para 574 mil toneladas de pescado nesse período (EMBRAPA, 2016). Em termos de consumo de proteína de fontes aquáticas (peixes, crustáceos, moluscos e etc.), os maiores aumentos no consumo ocorreram na Oceania e na Ásia e especialmente na China, onde o consumo aumentou de 11 g para 69 g por pessoa por dia no período de 1963 a 2003 (Stentiford et al., 2012).
Até 2050, a aquicultura precisará atingir produção de 231 milhões de toneladas (quase o dobro da produção atual) para suprir a demanda global (Kearney, 2010). Tendo em conta as limitações da pesca para proporcionar uma maior oferta durante este período, a aquicultura e, em particular, a proveniente do ambiente marinho, tem potencial para preencher o déficit e para fornecer alimento suficiente para suprir a demanda futura por frutos-do-mar. Os camarões marinhos formam a proporção mais significativa do setor de aquicultura de crustáceos com aproximadamente 7,9 milhões de toneladas produzidas em 2016 (FAO 2018). Enquanto a produção pesqueira permaneceu praticamente estática, a produção aquícola de espécies chave, incluindo o camarão-branco-do-Pacífico (Penaeus vannamei), sofreu uma rápida expansão global desde 2000 e rende cerca de 9 bilhões de dólares por ano. O camarão tigre (Penaeus monodon) acrescenta mais 3 bilhões de dólares por ano em valor de produção (FAO 2018). A carcinicultura é predominantemente praticada na América Central e do Sul e na Ásia, particularmente na China. O consumo de camarão ocorre mais amplamente e as exportações são focadas nos EUA, no Japão e na União Europeia (Stentiford et al., 2012).
Os crustáceos decápodes podem hospedar uma ampla gama de patógenos e parasitas. No Entanto, patógenos virais parecem exercer as restrições mais significativas sobre o crescimento e sobrevivência de crustáceos em condições de cultivo. Cerca de 60% das atuais perdas associadas à doença na aquicultura de camarão podem ser devidas a patógenos virais, com mais de 20% devido a patógenos bacterianos, enquanto as perdas associadas a agentes fúngicos e parasitários são menores (Flegel, 2006, 2012). Infecções virais foram encontradas em crustáceos selvagens e cultivados, desde sua descoberta inicial nos anos 60 (Vago, 1966), mais de 50 vírus foram descritos de diversos grupos de crustáceos. Devido ao seu maior tamanho e característica patológica, os vírus de DNA foram descritos, em sua maioria, em grupos de hospedeiros estudados com qualquer nível de detalhe (por exemplo: Takahashi et al., 1994; e Stentiford, 2008; Behringer et al. 2011). Vírus com genomas de RNA, alguns dos quais têm consequências devastadoras para animais cultivados, também estão sendo cada vez mais descritos, particularmente em camarões peneídeos em sistemas de cultivo intensivo (por exemplo, ver Boonyaratpalin et al., 1993; Hasson et al.,1995; Poulos et al., 2006; Lightner, 2011).
Em termos gerais, desde o início da indústria, a carcinicultura tem sido prejudicada pelos patógenos que continuam surgindo apesar dos esforços para criar estoques livres de patógenos específicos (SPF). Pois, embora as linhagens SPF estejam livres de patógenos listados (frequentemente aqueles listados pela Organização Mundial de Saúde Animal – OIE), não devem ser consideradas “livre de patógenos” (por exemplo, é difícil excluir a presença de Vibrio spp. em camarões SPF), nem resistentes a esses patógenos listados (Moss et al. 2012).
Infelizmente, a emergência e disseminação de doenças corresponde às más práticas da indústria. Moss et al. (2012) afirmam que a água de abastecimento das fazendas é o caminho mais significativo para a entrada de patógenos no sistema de cultivo, e contribui ainda mais para o surgimento de novas doenças, mesmo em estoques de camarão originalmente SPF. A tecnologia Biofloc (BFT) é a tentativa mais recente de cultivar intensivamente camarões com troca zero de água, e tem o potencial para produzir com sucesso até 20 toneladas por hectare (Taw, 2010). Moss et al. (2012) resumem que um maior foco em práticas de gestão integrada (por exemplo, estocagem de larvas SPF em fazendas BFT) permite aos carcinicultores a concentrar as pressões de seleção no crescimento e sobrevivência, ao invés de resistência a doenças, e isso pode levar ao aumento da produção e rentabilidade, além de limitar a disseminação de patógenos em estoques selvagens.
Antes de 1990, devido ao limitado movimento transfronteiriço de animais da aquicultura e seus produtos, os agentes patogênicos que afetam a produção de camarão foram em grande parte confinados a localizações geográficas específicas (Stentiford et al., 2012). A expansão da indústria, e a comercialização de reprodutores, larvas e produtos derivados da carcinicultura cada vez mais globalizada levaram ao surgimento de várias condições de doença em ambas as Américas (por exemplo, Necrose Infecciosa Hipodermal e Hematopoiética – IHHNV, Hepatopancreatite Necrosante – NHP, Síndrome de Taura – TSV, Mionecrose Infecciosa – IMNV) e na Ásia (Doença da Yellowhead – YHD, Síndrome da Mancha Branca – WSSV). A maioria dessas doenças causaram problemas significativos na produção em regiões de cultivo distantes do seu local original de emergência.
Além disso, embora a domesticação do camarão-branco-do-Pacífico (Penaeus vannamei), seja claramente um grande avanço em termos de melhoria de produção, também pode ser que a concentração do esforço global em produzir uma única espécie de camarão certamente ajudou na translocação de patógenos importantes para regiões distantes (por exemplo, O vírus da Mionecrose tem sido endêmico em fazendas de camarão na Indonésia desde 2006, após seu surgimento no Brasil em 2002). O cultivo de P. vannamei em novos locais geográficos também pode aumentar o potencial de surgimento de novas doenças nesta espécie, particularmente onde o estoque cultivado é mantido em viveiros com contato direto com a água local e sua vida selvagem (Stentiford et al., 2012).
Em outros cenários, algumas doenças também surgiram no camarão peneídeo devido a oferta de carcaças de não-peneídeos como alimento em cultivo, este caminho pode ter sido responsável pelo surgimento do Vírus da Mancha Branca (WSSV) em camarões peneídeos na Ásia, pois os reprodutores de camarão comumente eram alimentados com caranguejos importados no período anterior ao surto (Stentiford et al., 2012).
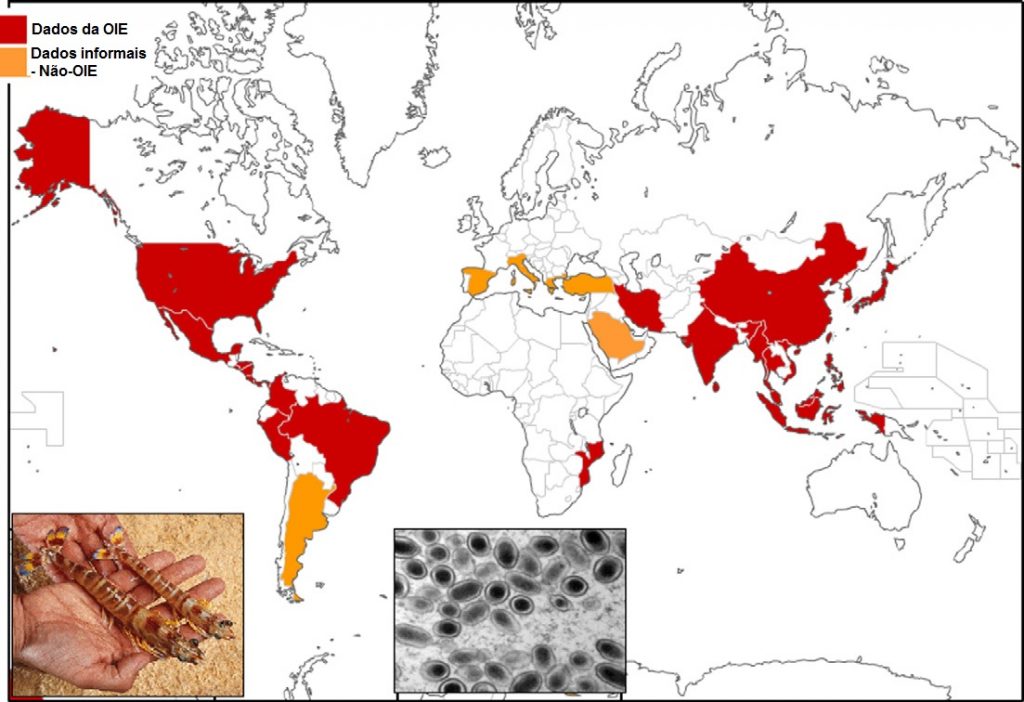
O WSSV fornece o exemplo mais notável de um patógeno impactando negativamente a produção de alimentos do setor de aquicultura de crustáceos. Apesar de mais de duas décadas desde o seu surgimento na Ásia, o WSSV continua a prejudicar a aquicultura em grandes regiões produtoras na Ásia e nas Américas, e ameaçar novos locais onde as operações de cultivo de camarão estão iniciando (OIE, 2009) (Fig. 1). Usando dados de várias fontes, Lightner et al. (2012) estimam que as perdas globais da produção devido ao WSSV seja de pelo menos 8 bilhões de dólares desde o seu surgimento no início dos anos 90, mas também afirmam que as perdas reais podem estar próximas a 15 bilhões de dólares. Neste contexto, supera o impacto de vários outros patógenos importantes de crustáceos atualmente listado pela OIE: IHHNV (1 bilhão de dólares), YHD (0,5 bilhões de dólares), TSV (3 bilhões de dólares) e IMNV (1 bilhão de dólares). Considerando o valor mais alto da perda de produção anual, isso equivale a uma perda de aproximadamente 1 bilhão de dólares por ano para a carcinicultura global associada ao WSSV. Com base na produção anual de cerca de 10 bilhões de dólares, cerca de 10% da produção é perdida a cada ano apenas para o WSSV (Stentiford et al., 2012). Em conjunto, os cinco principais agentes patogênicos virais (WSSV, YHV, TSV, IHHNV e IMNV) podem representar perdas anuais adicionais de aproximadamente 500 milhões de dólares, gerando uma perda total anual de 1,5 bilhões de dólares (ou 15% da produção). Se considerarmos as taxas de perda de produção por WSSV (10% do total) e as cinco principais doenças virais (15% do total), equivale ao total que é importado para os Estados Unidos e União Europeia combinados (Stentiford et al., 2012).
Para diminuir as perdas por patógenos na carcinicultura, novas abordagens para melhorar o rendimento são requeridos urgentemente, incluindo melhorias nas práticas de cultivo e desenvolvimento de pesquisas de ponta que visam aproveitar as habilidades naturais dos invertebrados para mitigar a ação de patógenos. Hauton (2012) analisa potenciais abordagens para a manipulação da resposta imune de crustáceos para fins de profilaxia na aquicultura. Ele afirma que, a análise de patógenos em populações selvagens podem ser utilizadas como ferramenta para identificar marcadores de desempenho que podem ter relevância direta para a aplicação na aquicultura. Hauton (2012) identificou cinco potenciais vias para o desenvolvimento de pesquisas: (1) Investigações sobre a diversidade de potenciais receptores imunológicos e regulatórios (como DSCAM); (2) Estudos sobre o amplo espectro de peptídeos antimicrobianos produzidos por crustáceos; (3) Compreensão sobre a base para a proliferação de hemócitos in vitro; (4) Compreensão do papel do intestino na imunidade; e finalmente; (5) Estudos moleculares da interação patógeno-hospedeiro (sintetizado por recentes avanços com interferência viral e estratégias de RNA de interferência).
Especificamente para o último exemplo, em seu artigo, Bartholomay et al. (2012) demonstraram que o aumento do RNA de interferência (RNAi) em camarão para suprimir a infecção por doença viral é uma abordagem promissora para o controle de doenças virais em camarão. Resumidamente, os fragmentos curtos de RNA reconhecem e se ligam a sequências complementares de dsRNA, impedindo assim a expressão gênica específica (por exemplo, de um vírus) de uma sequência específica (para mais detalhes assista o vídeo RNA interference (RNAi) by Nature Video, no link abaixo:
Assim, é considerado que as vias naturais de RNAi desempenham papel crítico na resposta imune inata a infecções virais e, portanto, oferecem um potencial significativo para o desenvolvimento de profilaxia para uso na aquicultura (Bartholomay et al., 2012).
No geral, a crescente demanda por frutos-do-mar associada a alta taxa de emergência de novas doenças em crustáceos, a capacidade limitada para mitigar as doenças e o mal manejo de cultivo sinalizam uma clara advertência para a futura sustentabilidade da carcinicultura. A ligação entre especialistas de aquicultura com patologistas, epidemiologistas, ecologistas e formuladores de políticas públicas no campo da segurança alimentar permitirá que esses gargalos sejam mais bem identificados e abordados para buscar soluções para que a carcinicultura possa suprir a demanda de alimentos no futuro.
REFERÊNCIAS BIBLIOGRÁFICAS:
Anderson, K., 2010. Globalization’s effects on world agricultural trade, 1960–2050. Phil. Trans. R. Soc. B 365, 3007–3021.
Bartholomay, L.C., Loy, D.S., Loy, J.D., Harris, D.L.H., 2012. Nucleic-acid based antivirals: augmenting RNA interference to ‘vaccinate’ Litopenaeus vannamei. J. Invertebr. Pathol. 110, 261–266.
Behringer, D.C., Butler, M.J., Shields, J.D., Moss, J., 2011. Review of Panulirus argus virus 1—a decade after its discovery. Dis. Aquat. Org. 94, 153–160.
Boonyaratpalin, S., Supamataya, K., Kasornchandra, J., Direkbusarakom, S., Ekpanithanpong, U., Chantanachookin, C., 1993. Non-occluded baculo-like virus the causative agent of yellow-head disease in the black tiger shrimp Penaeus monodon. Fish Pathol. 28, 103–109.
Embrapa. 2016. Aquicultura brasileira cresce 123% em dez anos. Brasília, Brasil. https://www.embrapa.br/busca-de-noticias/-/noticia/18797150/aquicultura-brasileira-cresce-123-em-dez-anos
FAO. 2018. The state of world fisheries and aquaculture 2016, 176 p. Rome, Italy, FAO. <http://www.fao.org/fishery/sofia/en>.
Fischer, R.A., Byerlee, D., Edmeades, G.O. 2009. Can technology deliver on the yield challenge to 2050? Paper for an Expert Meeting on How to feed the World in 2050, Food and Agriculture Organization, Rome, Italy.
Flegel, T.W., 2006. Disease testing and treatment. In: Boyd, C.E., Jory, D., Chamberlain, G.W. (Eds.), Operating Procedures for Shrimp Farming, Global Shrimp OP Survey Results and Recommendations. Global Aquaculture Alliance, St. Louis, pp. 98–103.
Flegel, T.W., 2012. Historic emergence, impact and current status of shrimp pathogens in Asia. J. Invertebr. Pathol. 110, 166–173.
Hasson, K.W., Lightner, D.V., Poulos, B.T., Redman, R.M., White, B.L., Brock, J.A., Bonami, J.R., 1995. Taura syndrome in Penaeus vannamei: demonstration of a viral etiology. Dis. Aquat. Org. 23, 115–126.
Hauton, C., 2012. The scope of the crustacean immune system for disease control. J. Invertebr. Pathol. 110, 251–260.
Kearney, J., 2010. Food consumption trends and drivers. Phil. Trans. R. Soc. B 365, 2793–2807.
Lightner, D.V., 2011. Virus diseases of farmed shrimp in the Western Hemisphere (the Americas): A review. J. Invertebr. Pathol. 106, 110–130.
Moss, S.M., Moss, D.R., Arce, S.M., Lightner, D.V., Lotz, J.M., 2012. The role of selective breeding and biosecurity in the prevention of disease in penaeid shrimp aquaculture. J. Invertebr. Pathol. 110, 247–250.
Poulos, B.T., Tang, K.F.J., Bonami, J.R., Lightner, D.V., 2006. Purification and characterization of infectious myonecrosis virus of penaeid shrimp. J. Gen. Virol. 87, 987–996.
Steinfeld, H., Gerber, P., Wassenaar, T., Castel, V., Rosales, M., de Haan, C., 2006. Livestock’s Long Shadow. Environmental Issues and Options. Livestock, Environment and Development Initiative. United Nations Food and Agriculture Organization, Rome, Italy.
Stentiford, G.D., 2008. Diseases of the European edible crab (Cancer pagurus): a review. ICES J. Mar. Sci. 65, 1578–1592.
Stentiford, G.D., Neil D.M., Peeler E.J., Shields J.D., Small H.J., Flegel T.W., Vlak J.M., Jones B., Morado F., Moss S., Lotz J., Bartholomay L., Behringer D.C., Hauton C., Lightnerm D.V. 2012. Disease will limit future food supply from the global crustacean fishery and aquaculture sectors. Journal of Invertebrate Pathology. 110,141–157.
Takahashi, Y., Itami, T., Kondom, M., Maeda, M., Fuji, R., Tomonaga, S., Supamattaya, K., Boonyaratpalin, S., 1994. Electron microscopic evidence of baciliform virus infection in Kuruma shrimp (Penaeus japonicus). Fish Pathol. 29, 121–125.
Taw, N., 2010. Biofloc technology expanding at white shrimp farms. Glob. Aquac. Advocate..
Thornton, P.K., 2010. Livestock production: recent trends, future prospects. Phil. Trans. R. Soc. B 365, 2853–2867.
Vago, C., 1966. A virus disease in Crustacea. Nature 209, 1290.
 Cartilha de Rastreabilidade: Ostras cultivadas - Projeto AquiNordeste (Livro Digital - PDF).
Cartilha de Rastreabilidade: Ostras cultivadas - Projeto AquiNordeste (Livro Digital - PDF).
 Camarões Marinhos Reprodução, Maturação e Larvicultura (Livro Impresso)
R$50,00
Camarões Marinhos Reprodução, Maturação e Larvicultura (Livro Impresso)
R$50,00
 Recursos naturais na vida caiçara (livro digital - PDF)
R$0,00
Recursos naturais na vida caiçara (livro digital - PDF)
R$0,00
 Aquicultura no Brasil: o desafio é crescer (Livro Digital -PDF)
R$0,00
Aquicultura no Brasil: o desafio é crescer (Livro Digital -PDF)
R$0,00
 Água no setor industrial da região do Alto Iguaçu e dos afluentes do Alto Ribeira... (Versão Digital - PDF)
R$0,00
Água no setor industrial da região do Alto Iguaçu e dos afluentes do Alto Ribeira... (Versão Digital - PDF)
R$0,00
 Piscicultura - Fundamentos e Técnicas de Manejo (Livro Digital - PDF)
R$0,00
Piscicultura - Fundamentos e Técnicas de Manejo (Livro Digital - PDF)
R$0,00
 FAO: Agricultura Irrigada Sustentável no Brasil - Identificação de Áreas... (Livro Digital - PDF)
R$0,00
FAO: Agricultura Irrigada Sustentável no Brasil - Identificação de Áreas... (Livro Digital - PDF)
R$0,00
 Rastreabilidade na ostreicultura: conceitos, fundamentos e casos... (livro digital - PDF)
R$0,00
Rastreabilidade na ostreicultura: conceitos, fundamentos e casos... (livro digital - PDF)
R$0,00
 As lendas na educação caiçara (livro digital - PDF)
R$0,00
As lendas na educação caiçara (livro digital - PDF)
R$0,00
 As lendas na educação - Estórias do Baixo Sul e do Recôncavo Baiano (livro digital - PDF)
R$0,00
As lendas na educação - Estórias do Baixo Sul e do Recôncavo Baiano (livro digital - PDF)
R$0,00
O GIA é um grupo de pesquisas científicas, tecnológicas e de inovação criado e sediado na Universidade Federal do Paraná. Sua principal missão é assumir um papel direto na interação entre setor acadêmico, a iniciativa privada e a sociedade civil em geral, transpondo os muros universitários, aplicando com excelência e eficiência, métodos técnico-científicos de produção de alimentos e na resolução de problemas ambientais, sociais e econômicos que dizem respeito aos mais diferentes setores da sociedade brasileira.
No dia 09 de fevereiro de 2021 foi finalmente assinado o Termo de Compartilhamento estabelecido entre a UFPR, através de...
O GIA acaba de lançar mais um livro. O tema da vez é o cultivo de peixes orgânicos Cada vez...
Copyright © Grupo Integrado de Aquicultura e Estudos Ambientais (GIA) | Desenvolvido por Abrigo Virtual
Copyright © Grupo Integrado de Aquicultura e Estudos Ambientais (GIA) | Desenvolvido por Abrigo Virtual