Parceria GIA-ATGC
No dia 09 de fevereiro de 2021 foi finalmente assinado o Termo de Compartilhamento estabelecido entre a UFPR, através de...
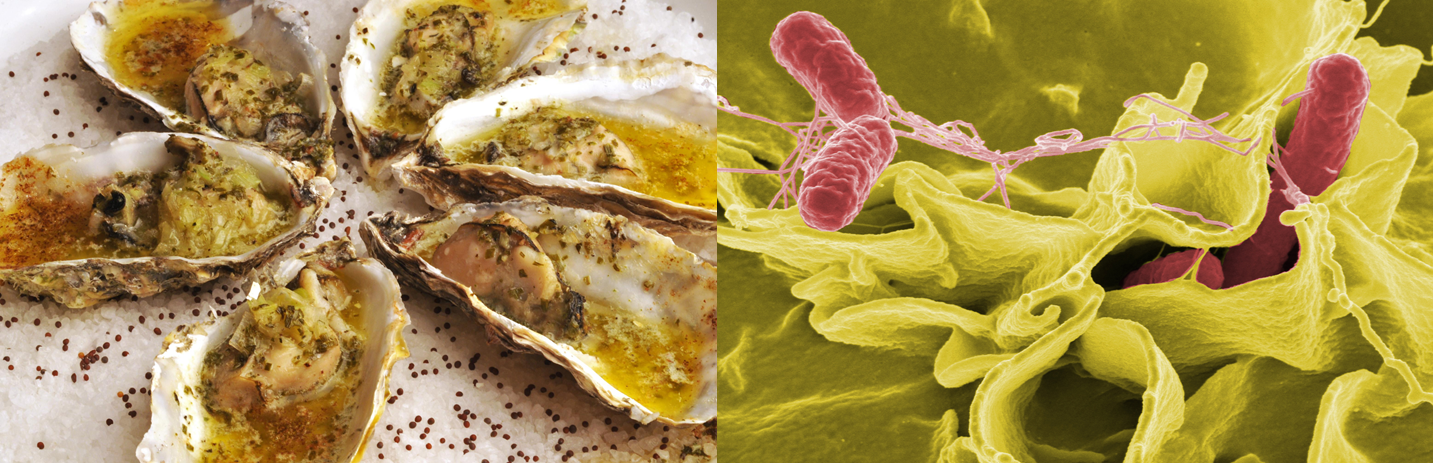
Segurança Alimentar: Contaminação de ostras por Salmonella sp.
Por Aline Horodesky
Publicado em 25/05/2015
As ostras possuem hábito alimentar filtrador, alimentando-se principalmente de partículas em suspensão na água. Suas duas valvas são mantidas relativamente abertas por onde entra a água com o alimento. Mais especificamente, a alimentação provém de um fluxo de água, que passa através das cavidades do manto, após passa pelas brânquias, as quais funcionam como um filtro que concentram partículas orgânicas, algas microscópicas e organismos planctônicos.
Figura 1: Anatomia interna das ostras. Fonte: GIA
A capacidade filtradora de uma ostra é de aproximadamente 10 litros de água por hora e cerca de 200 a 250 litros por dia. Por apresentar essa capacidade, são consideradas também reservatórios de inúmeros patógenos humanos, já que podem bioacumular primariamente bactérias, como as dos gêneros Salmonella e Shigella, vírus entéricos e protozoários, devido à possíveis contaminações fecais nos locais de cultivo.
Além disso, a ostra está entre um dos principais grupos de alimentos relacionados à ocorrência de Doenças Transmitidas por Alimentos – DTAs.
Quando ostras, ao serem ingeridas crus (in natura) ou mal cozidas, funcionam como veículos de transmissão, podendo provocar sintomas e doenças sérias aos seres humanos. Caso o processamento e preparo não seja realizado de forma correta para remover (depuração) ou destruir (cozimento) os micro-organismos patogênicos ou toxinas, o consumo de ostras pode representar um perigo à saúde pública.

Figura 2: Ostras in natura para consumo humano. Fonte: Enoeventos
Outro fator que influencia na qualidade das ostras é o tempo de deterioração (influenciada pela quantidade e pelo tipo de micro-organismos presentes inicialmente) das ostras após serem retiradas da água. Durante o processo de transporte e estocagem, os fatores desfavoráveis como menos oxigênio, acúmulo de dejetos e interrupção da alimentação promovem uma alteração na microbiota. Além desses fatores, a temperatura de estocagem exerce uma forte influência na diversidade desta microbiota.
A taxa de multiplicação dos micro-organismos é altamente dependente da temperatura. A maioria dos patógenos tem sua multiplicação reduzida a 10 °C, sendo que 4 °C está abaixo da temperatura mínima de multiplicação. A contagem bacteriana total apresenta o menor tempo de geração a 30 °C, sendo que a 3,6 °C a velocidade de multiplicação bacteriana é mínima em ostras naturalmente contaminadas.
O período necessário para eliminar 90% da contaminação em águas salinas varia conforme os micro-organismos envolvidos. Neste caso, em ostras, o tempo necessário para eliminação de Salmonella é de aproximadamente 56 a 80 horas. Estas ostras contaminadas, devem passar por um processo de depuração, a qual esta associada ao tratamento da água com recirculação em um sistema equipado com ultravioleta e água tratada com cloro.
Figura 3: Tanque utilizado para depuração de ostras produzidas em Paranaguá/PR. Fonte: Everson Bressan-AENotícias.
O gênero Salmonella pertence à família Enterobacteriaceae. Esses organismos são quimiorganotróficos, anaeróbios facultativos com metabolismo tanto fermentativo, como respiratório. São patógenos causadores de febre tifóide, febre entérica, gastroenterites e septicemia (infecção sistêmica severa). São também responsáveis pelos grandes surtos de gastroenterites de ocorrência mundial, apresentando uma dose infectiva a partir de 102 UFC/g de carne, dependendo da linhagem.
A Salmonella sp. é amplamente distribuída na natureza, sendo encontrada principalmente no trato intestinal do homem e de animais de sangue quente e frio, com exceção dos peixes, moluscos e crustáceos, que podem contaminar-se após a pesca ou extração.
Países com elevadas taxas de produção de moluscos bivalves exigem, em suas regulamentações, a ausência do gênero Salmonella nas ostras.
No Brasil, os surtos de doenças veiculadas por consumo de ostras contaminadas certamente ocorrem, porém os altos índices de subnotificação acompanhados ao elevado número de turistas de diversas regiões do Brasil e do mundo contribuem para a falta de um maior conhecimento destes dados.
Portanto, considerando que o consumo de ostras in natura pode representar um perigo à saúde do consumidor, o monitoramento da sua qualidade microbiológica é fundamental nas áreas de cultivo e, principalmente, nos pontos de comercialização, tendo em vista que a estocagem inadequada pode elevar os níveis de contaminação.
Como resultado disso, o GIA desenvolve vários projetos com o intuito de avaliar toda a cadeia produtiva da ostreicultura em diversas regiões do Brasil. O principal foco destes projetos está na avaliação das condições microbiológicas das ostras tanto produzidas como comercializadas, resultando em informações das etapas da produção desses animais até chegar ao consumidor final.
Referências Consultadas
Correa, A. A. 2006. Estudo sobre a dinâmica de depuração de ostras de cultivo (Crassostrea gigas) artificialmente contaminadas com Salmonella enterica sorovar Typhimurium. Dissertação de Mestrado. Universidade Federal de Santa Catarina.
Corrêa, A. A.; Albarnaz, J. D.; Moresco, V.; Poli, C. R.; Teixeira, A. L.; Simões, C. M. O.; Barardi, C. R. M. 2007. Depuration dynamics of oysters (Crassostrea gigas) artificially contaminated by Salmonella enterica serovar Typhimurium. Marine Environmental Research, v. 63, p. 479-489.
Costa, R. A.; Vieira, G. H. F.; Silva, G. C.; Peixoto, J. R. O; Brito, M. V. 2007. Bactérias de interesse sanitário em sushi comercializado em Sobral – Ceará. Boletim Téc. Cient. CEPENE. Tamandaré, v. 15, n. 1, p. 15-19.
Farias, H. 2008. Qualidade higiênico-sanitária na cadeia produtiva de ostras, Crassostrea sp., cultivadas na baía de Guaratuba, PR, Brasil. Dissertação de Mestrado. Universidade Federal do Paraná.
FDA – Food and Drug Administration. 2001. National Food Safety Programs.
Fernandez-Piquer, J., Bowman, J.P., Ross, T., Tamplin, M.L., 2012. Molecular analysis of the bacterial communities in the live Pacific oyster (Crassostrea gigas) and the influence of postharvest temperature on its structure. J. Appl. Microbiol. 112, 1134e1143.
Gabutti, G.; De Donno, A.; Bagordo, F. 2000. Comparative survival of faecal and human contaminants and use of Staphylococcus aureus as na effective indicator of human pollution. Marine Pollution Bulletin, v. 40, n. 8, p. 697-700.
Holt, J. G. 1994. Bergey´S Manual Of Determinative Bacteriology. 9th edition, 787 p.
Jones D. D.; Bej, A. K. 1993. Detection of Salmonella spp. in oysters using Polymerase chain reaction (PCR) and gene probes. Journal of food sciences, v. 58, p. 1191-1197.
Lee, C. Y.; Panicker, G.; Bej, A. K. 2003. Detection of pathogenic bacteria in shellfish using multiplex PCR followed by CovaLinkTM NH microwell plate sandwich hybridization. Journal of Microbiological Methods. v.53, p.199-209.
Li, X., Boudjellab, N., Zhao, X. 2000. Combined PCR and slot blot assay for detection of Salmonella and Listeria monocytogenes. International Journal of Food Microbiology, v. 56, p. 167-177.
Pereira, A. M. 2006 Microbiological quality of oysters (Crassostrea gigas) produced and commercializes in the coastal region of Florianópolis – Brazil.
Robertson, L. J. 2007. The potential for marine bivalve shellfish to act as transmission vehicles for outbreaks of protozoan infections in humans: a review. International Journal of Food Microbiology, v. 120, p. 201-216.
Steinert, S. A.; Streib-Montee, R.; Learher, J. M. 1998. DNA damage in mussel at sites in San Diego Bay. Mutation Research, v. 399, p. 65-85.
Ward, J. E. 1996. Biodynamics of suspension-feeding in adult bivalve molluscs: particle capture, processing and fate. Invertebrate Biology, v.115, n.3, p. 218-231.
 Piscicultura - Fundamentos e Técnicas de Manejo (Livro Digital - PDF)
R$0,00
Piscicultura - Fundamentos e Técnicas de Manejo (Livro Digital - PDF)
R$0,00
 A produção integrada na carcinicultura brasileira (Volume 2) - (Livro Digital - PDF)
R$0,00
A produção integrada na carcinicultura brasileira (Volume 2) - (Livro Digital - PDF)
R$0,00
 Fichas Técnicas Ilustradas - Sebrae/Projeto AquiNordeste (Livro Digital - PDF)
R$0,00
Fichas Técnicas Ilustradas - Sebrae/Projeto AquiNordeste (Livro Digital - PDF)
R$0,00
 Aquicultura: Uma visão geral sobre a produção de organismos aquáticos no Brasil... (Livro digital - PDF)
R$0,00
Aquicultura: Uma visão geral sobre a produção de organismos aquáticos no Brasil... (Livro digital - PDF)
R$0,00
 Aquicultura no Brasil: o desafio é crescer (Livro Digital -PDF)
R$0,00
Aquicultura no Brasil: o desafio é crescer (Livro Digital -PDF)
R$0,00
 As lendas na educação caiçara (livro digital - PDF)
R$0,00
As lendas na educação caiçara (livro digital - PDF)
R$0,00
 Um pouco de tudo o que você sempre quis saber sobre o cultivo de peixes orgânicos (livro digital - PDF)
R$0,00
Um pouco de tudo o que você sempre quis saber sobre o cultivo de peixes orgânicos (livro digital - PDF)
R$0,00
 FAO: Agricultura Irrigada Sustentável no Brasil - Identificação de Áreas... (Livro Digital - PDF)
R$0,00
FAO: Agricultura Irrigada Sustentável no Brasil - Identificação de Áreas... (Livro Digital - PDF)
R$0,00
 Rastreabilidade na ostreicultura: conceitos, fundamentos e casos... (livro digital - PDF)
R$0,00
Rastreabilidade na ostreicultura: conceitos, fundamentos e casos... (livro digital - PDF)
R$0,00
 As lendas na educação - Estórias do Baixo Sul e do Recôncavo Baiano (livro digital - PDF)
R$0,00
As lendas na educação - Estórias do Baixo Sul e do Recôncavo Baiano (livro digital - PDF)
R$0,00
O GIA é um grupo de pesquisas científicas, tecnológicas e de inovação criado e sediado na Universidade Federal do Paraná. Sua principal missão é assumir um papel direto na interação entre setor acadêmico, a iniciativa privada e a sociedade civil em geral, transpondo os muros universitários, aplicando com excelência e eficiência, métodos técnico-científicos de produção de alimentos e na resolução de problemas ambientais, sociais e econômicos que dizem respeito aos mais diferentes setores da sociedade brasileira.
No dia 09 de fevereiro de 2021 foi finalmente assinado o Termo de Compartilhamento estabelecido entre a UFPR, através de...
O GIA acaba de lançar mais um livro. O tema da vez é o cultivo de peixes orgânicos Cada vez...
Copyright © Grupo Integrado de Aquicultura e Estudos Ambientais (GIA) | Desenvolvido por Abrigo Virtual
Copyright © Grupo Integrado de Aquicultura e Estudos Ambientais (GIA) | Desenvolvido por Abrigo Virtual