Parceria GIA-ATGC
No dia 09 de fevereiro de 2021 foi finalmente assinado o Termo de Compartilhamento estabelecido entre a UFPR, através de...

Gisela Geraldine Castilho-Westphall (10/05/2014)
O Sonar de Varredura Lateral (SVL) é um método indireto de aquisição de dados baseado na propagação do som na água. É um sistema ativo de sensoriamento remoto que emite e registra ondas acústicas, gerando imagens (registros sonográficos) do leito do mar, lagos, lagoas, rios, entre outros.
Para que o equipamento mapeie as regiões submersas, ele deve ser rebocado por uma embarcação próximo a superfície da coluna d’água, enquanto o sinal atinge o fundo, interage com o sedimento e retorna ao sensor. Este método é muito semelhante ao que foi utilizado há alguns anos na Escócia, para procurar o monstro do Lago Ness. Agora, ao invés de procurar um monstro, o GIA fez uso de um Sonar para estimar a população de ostras de interesse comercial em bancos naturais submersos.
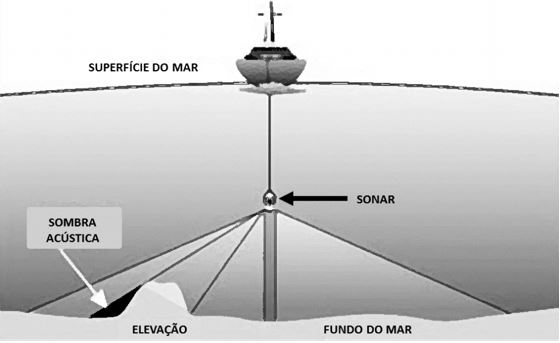
Figura 1. Representação do sistema de funcionamento de um sonar de varredura lateral (SVL). Adaptado de http://gralston1.home.mindspring.com/Sidescan.html
Essa pesquisa é consequência da preocupação com os efeitos do extrativismo, sobre as populações de ostras no ambiente natural. Isto porque, diariamente, ostras nativas são extraídas em, praticamente, todo o litoral brasileiro para obtenção de formas jovens (sementes) para abastecer cultivos e/ou para a captura de indivíduos adultos para consumo.
Séculos de extração de recursos, agravados pela degradação costeira levaram os bancos de ostras à beira da extinção em muitos países, tanto é, que globalmente, estima-se que 85% dos bancos naturais estejam liquidados.
Em 2011, Beck e colaboradores publicaram os resultados de um estudo desenvolvido no período de 1995 a 2004 na região costeira do Brasil. Estes autores classificaram alguns manguezais da costa brasileira como “bons”, quando havia uma perda menor que 50% na abundância de ostras, e “razoáveis”, quando a redução ultrapassava 50%, chegando a alarmantes 89% de redução.
Acredita-se, portanto, que a exploração com objetivos comerciais de ostras no Brasil, de forma exploratória e sem o correto gerenciamento, seja determinante para o declínio dos estoques naturais.
Porém, se a construção de um plano eficiente de gerenciamento dos estoques passa pelo conhecimento e a quantificação das populações de ostras presentes no ambiente, como analisar bancos de ostras submersos? A situação é ainda pior quando os bancos ficam em águas turvas e de iluminação precária.
Entre as metodologias de prospecção disponíveis atualmente, o SVL é uma grande promessa para a descrição quantitativa de distribuição e extensão dos habitats bentônicos (submersos). Em pesquisas realizadas na Nova Zelândia, este tipo de sonar mostrou-se uma ferramenta muito útil sob vários aspectos, para a gestão dos bancos de ostras.Além disso, sua utilização permitiu mapear grandes áreas em um período relativamente curto de tempo, obtendo-se coordenadas de georreferenciamento a partir de qualquer localização na imagem, sem que a turbidez da água ou a luminosidade do ambiente influenciassem nos resultados. Porém, no Brasil, este procedimento era inédito até pouco tempo atrás.
Ao pesquisar a extensão e a quantidade de indivíduos presentes em bancos naturais de ostras de infralitoral, o GIA tornou-se pioneiro no Brasil ao realizar, com sucesso, a prospecção do ambiente com SVL.
A área utilizada para estudo foi a baía de Guaratuba (25°52’S, 48°39’W), situada ao sul do Brasil e com uma área total de 48,72 km2. Dez bancos naturais submersos foram selecionados ao acaso, georreferenciados (marcadas as coordenadas geográficas) e prospectados (mapeados pelo uso do Sonar), conforme localização indicada no mapa abaixo.
Figura 2. Bancos naturais de ostras em infralitoral, na Baía de Guaratuba. Os pontos 1 a 10 indicam os bancos prospectados com o SONAR. 1=Rio Barigui; 2=Furado do Quilombo; 3-Furado do Braço Seco; 4=Sambaqui do Braço Seco; 5=Barigui; 6=Baixio das Ostras; 7=Sambaqui das Cruzes; 8=Sambaqui das Laranjeiras (rio das Laranjeiras); 9=Miringuava; 10=Ariri.
As linhas prospectadas acompanharam o leito dos rios, paralelamente às margens e incluíram os bancos inteiros, do início até o fim. Como método confirmatório de identificação, moradores da região, que extraem ostra rotineiramente, realizaram mergulho em apneia para coletar amostras de 20 ostras/banco, para análises laboratoriais. Estas análises indicaram que, das 158 ostras analisadas, 96% eram da espécie Crassostrea brasiliana e 4% Crassostrea sp. (também denominada C. mangle)
Percorreu-se com o SVL uma área total de 98.010 m², onde foram observados conjuntos de ostras dispersos no leito dos rios de forma descontínua e com tamanho variável. Cada conjunto de ostras apresentou em média 1,5 m de extensão (mínimo 0,2 e máximo 8,0 m), totalizando 1.107 conjuntos de ostras. A extensão total ocupada pelos bancos foi de 1.633,5 m.
Figura 3. Imagem gerada pelo equipamento de SONAR. Conjunto de ostras (O), de 2,2 m de diâmetro, no leito do rio Barigui (ponto 1). A linha vertical ao centro (l) indica a coluna d’água disposta logo abaixo do sonar de varredura lateral (SVL) e a escala acima, valores em metros com campo de alcance máximo de 30 m para cada um dos lados.
A partir dos dados gerados, estimou-se que a quantidade total de ostras nos dez bancos analisados foi de 21.159,13 ostras, ou seja, 1.763,26 dúzias (1 ostra/4,5 m²).
Embora C. brasiliana seja descrita como uma espécie de grande porte, apenas um animal coletado era maior que 20 cm.Este resultado pode indicar uma diminuição da altura da população presente no infralitoral (ambiente em que as ostras permanecem submersas 100% do tempo), na baía de Guaratuba, possivelmente, como reflexo da exploração dos estoques, que pode já ter chegado ou estar chegando a tal ponto que dificulte sua recuperação natural.
Sabe-se que as populações de C. brasiliana provenientes de bancos naturais têm crescimento lento e, segundo alguns pesquisadores, 72% de uma população de mesolitoral (zona sujeita a variação de marés), demora quase 30 meses para aingir seu tamanho comercial mínimo, qe é de 50 mm.
Como a Captura por Unidade de Esforço (CPUE) para a baía de Guaratuba varia de 22,5 a 5.400 dúzias/extrator/ano e que um total de 1.763,26 dz. são estimados para os dez bancos pequisados, nota-se que a exploração exercida na região por um único extrator poderia ser maior que o total de animais quantificados neste ambiente. Além disso, a quantidade de ostras por unidade de área, verificada na baía de Guaratuba está próxima dos menores valores registrados para a espécie, em bancos de mesolitoral. No entanto, como a extração inclui bancos de mesolitoral e também ostras das três espécies existentes, há uma diluição da pressão sobre os bancos naturais de C. brasiliana, o que pode retardar, mas não evitar que a exploração desordenada impacte irreversivelmente esses bancos.
* Para maior detalhamento sobre o tema aqui apresentado, acesse:
http://cultimar.org.br/site/images/materiais/Ecologia%20da%20ostra%20do%20mangue.pdf
ALLEN, Y. C.; WILSON, C. A.; ROBERTS, H. F.; SUPAN, J. 2005. High-resolution mapping and classification of oyster habitats innearshore Louisiana using sidescan sonar. Estuaries. 28(3):435-446.
BECK, M. W.; BRUMBAUGH, R. D.; AIROLD, L.; CARRANZA, A.; COEN, L. D.; CRAWFORD, C.; DEEFO, O.; EDGAR, G. J.; HANCOCK, B.; KAY, M. C.; LENIHAN, H. S.; LUCKENBACH, M. W.; TOROPOVA, C. L.; ZHANG, G.; GUO, X. 2011. Recommendations for Conservation, Restoration, and Management. BioScience. 61(2):107-116.
brehmer, p.; gerlotto, f.; guillard, j.; fabien, s.; guénnegan, y.; buestel, d. 2003. New applications of hydroacoustic methods for monitoring shallow water aquatic ecosystems: the case of mussel culture grounds. Aquatic Living Resources 16:333–338.
BREHMER, P.; VERCELLI, C.; GERLOTTO, F.; SANGUINÈDE, F.; PICHOT, Y.; GUENNÉGAN, Y.; BUESTEL, D. 2006. Multibeam sonar detection of suspended mussel culture grounds in the open sea: Direct observation methods for management purposes. Aquaculture. 252:234-241.
BROWN, C. J.; SMITH S. J.; LAWTON, P.; ANDERSON, J. T. 2011. Benthic habitat mapping: a review of progress towards improved understandingof the spatial ecology of the seafloor using acoustic techniques. Estuarine, Coastal and Shelf Science 92:502-520.
CADERNAS, E. B. Status of molluscan aquaculture on the Pacific coast of Mexico. Aquaculture, 39(1-4): 83-93. 1984.
CHAVES, P.; BOUCHEREAU, J. 1999. Biodiversité et dynamique des peuplements ichtyiques de la mangrove de Guaratuba, Brésil. Oceanologica Acta. 22(3): 353-364.
CHRISTO, S. W. 2006. Biologia reprodutiva e ecologia de ostras do gênero Crassostrea Sacco, 1897 na baía de Guaratuba (Paraná – Brasil): um subsídio ao cultivo. Curitiba, 146 f. Tese (Doutorado em Ciências Biológicas- Zoologia), Universidade Federal do Paraná.
CODEX ALIMETARIUS. 1978. Código Internacional Recomendado de Prácticas de Higiene para Mariscos Moluscoides, CAC/RCP 18, 9:1-29.
COLLIER, J. S.; HUMBER, S. R. 2007. Time-lapse side-scan sonar imaging of bleached coral reefs:a case study from the Seychelles. Remote Sensing of Environment 108:339–356.
DALE, D.; CUEVAS, K.; BUCHANAN, M.; GORDON, S.; PERET, W. S. 2002. Side scan sonar in oyster management. IEEE. 141-145.
ERSE, E. B.; BERNARDES, M. A. 2008. Levantamento de estoques da ostra Crassostrea sp. em bancos naturais no litoral paranaense. Biotemas 21(2):57-63.
FAO – FOOD AND AGRICULTURE ORGANIZATION OF THE UNITED NATIONS. 2012. Species Fact Sheets Crassostrea gigas (Thunberg, 1793). Disponível em: http://www.fao.org/fishery/species/3514/en, acessado em: janeiro de 2012.
FELIX, L. A. 1996. Algumas considerações sobre levantamento hidrográfico em grande escala. Curso de Pós-Graduação em Ciências Geodésicas, Universidade Federal do Paraná. Curitiba,
GALTSOFF, P. S. 1964. The american oyster Crassostrea virginica (Gmelin, 1791). Fishery Bulletin of the Fish and Wildlife Service, 64:1-480.
GALVÃO, M. S. N.; PEREIRA, O. M.; HILSDORF, A. W. S. 2012. Molecular identification and distribution of mangrove oysters (Crassostrea) in an estuarine ecosystem in Southeast Brazil: implications for aquaculture and fisheries management. Aquaculture Research, 1–13.
GIA – GRUPO INTEGRADO DE AQUICULTURA E ESTUDOS AMBIENTAIS. 2011. Planos Locais de Desenvolvimento da Maricultura (PLDM’s). Ministério da Pesca e Aquicultura, no prelo.
Grizzle, R. E.; Brodeur, M. A.; Abeela, H. A.; Greene, J. K.; 2008. Bottom habitat maping using towed underwater videography: subtidal oyster reefs as an example application. Journal of Coastal Research 24, 103-109.
KOLM, H. E.; ABSHER, T. M. 2008. Bacterial density and coliform organisms in waters and oysters of Paranaguá Estuarine Complex, Paraná, Brazil. Boletim do Instituto de Pesca, São Paulo, 34(1):49-59.
LUDWIG, S.; PATELLA, R.; STOIEV, S.; CASTILHO-WESTPHAL, G. G.; GIROTTO, M. V. F.; OSTRENSKY, A. 2011. A molecular method to detect and identify the native species of southwestern Atlantic Crassotrea (Mollusca: Ostreidae). Zoologia. 28(4):420-426.
MANCERA, J.E.; MENDO, J. 1996. Population dynamics of the oyster Crassostrea rhizophorae from the Cienaga Grande de Santa Marta, Colombia. Fisheries Research. 26:139–148.
MELO, A. G. C.; VARELA, E. S.; BEASLEY, C. R.; SCHNEIDER, H.; SAMPAIO, I.; GAFFNEY, P. M.; REECE, K. S.; TAGLIARO, C. H. 2010. Molecular identification, phylogeny and geographic distribution of Brazilian mangrove oysters (Crassostrea). Genetics and Molecular Biology, 33(3):564-572.
OVERMEEREN, R.; CRAEYMEERSCH, J.; DALFSEN, J.; FEY, F.; HETEREN, S.; MEESTERS, E. 2009. Acoustic habitat and shellfish mapping and monitoring in shallow coastalwater – sidescan sonar experiences in the Netherlands. Estuarine, coastal and shelf science. 85:437–448.
PEREIRA, O. M.; MACHADO, I. C.; HENRIQUES, M. B.; GALVÃO, M. S. N.; BASTOS, A. A. 2000. Avaliação do estoque da ostra, Crassostrea brasiliana, no manguezal da região estuarino-lagunar de Cananéia (25°S; 48°W). Boletim do Instituto de Pesca, 26(1):49-62.
PEREIRA, O. M.; MACHADO, I. C.; HENRIQUES, M. B.; GALVÃO, M. S. N.; YAMANAKA, N. 2001. Avaliação do estoque da ostra Crassostrea brasiliana em rios e gamboas da região estuarino-lagunar de Cananéia (São Paulo, Brasil). Boletim do Instituto de Pesca, São Paulo, 27 (1): 85 – 95, 2001.
PEREIRA, O. M.; HENRIQUES, M. B.; MACHADO, I. C. 2003. Estimativa da curva de crescimento da ostra Crassostrea brasilianaem bosques de mangue e proposta para sua extração ordenadano estuário de Cananéia, SP, Brasil. Boletim do Instituto de Pesca, 29(1):19-28.
SAURIAU, P.; PICHOCKI-SEYFRIED, C.; WALKER, P.; DE MONTAUDOUIN, X.; PALUD, C.; HÉRAL, M. 1997. Crepidula fornicata L. (mollusque, gastéropode) en baie de Marennes-Oléron: cartographie des fonds par sonar à balayage latéral et estimation du stock. Oceanologica Acta. 21(2):353-362.
SMITH, G. F.; ROACH, E. B.; BRUCE, D. G. 2003. The location, composition, and origin of oyster bars in mesohaline Chesapeake Bay. Estuarine, Coastal and Shelf Science 56:391-409.
SONIAT, T. M.; M. S. BRODY. 1988. Field validation of a habitat suitability index model for the American oyster. Estuaries 11:87–95.
TWICHELL, D.; EDMISTON, L.; ANDREWS, B.; STEVENSON, W.; DONOGHUE, J.; POORE, R.; OSTERMAN, L. 2010. Geologic controls on the recent evolution of oyster reefs in Apalachicola Bay and St. George Sound, Florida. Estuarine, Coastal and Shelf Science 88:385-394.
 Aquicultura no Brasil: o desafio é crescer (Livro Digital -PDF)
R$0,00
Aquicultura no Brasil: o desafio é crescer (Livro Digital -PDF)
R$0,00
 Camarões Marinhos Reprodução, Maturação e Larvicultura (Livro Impresso)
R$50,00
Camarões Marinhos Reprodução, Maturação e Larvicultura (Livro Impresso)
R$50,00
 Água na indústria: uma análise da visão do setor industrial... (Versão Digital - PDF)
R$0,00
Água na indústria: uma análise da visão do setor industrial... (Versão Digital - PDF)
R$0,00
 Atlas Anatômico e Histológico do Caranguejo-uçá (Livro Impresso)
Atlas Anatômico e Histológico do Caranguejo-uçá (Livro Impresso)
 Rastreabilidade na ostreicultura: conceitos, fundamentos e casos... (livro digital - PDF)
R$0,00
Rastreabilidade na ostreicultura: conceitos, fundamentos e casos... (livro digital - PDF)
R$0,00
 Recursos naturais na vida caiçara (livro digital - PDF)
R$0,00
Recursos naturais na vida caiçara (livro digital - PDF)
R$0,00
 Manual de Boas Práticas: Qualidade e Segurança para Bons Negócios (livro digital - PDF)
R$0,00
Manual de Boas Práticas: Qualidade e Segurança para Bons Negócios (livro digital - PDF)
R$0,00
 Um pouco de tudo o que você sempre quis saber sobre o cultivo de peixes orgânicos (livro digital - PDF)
R$0,00
Um pouco de tudo o que você sempre quis saber sobre o cultivo de peixes orgânicos (livro digital - PDF)
R$0,00
 As lendas na educação caiçara (livro digital - PDF)
R$0,00
As lendas na educação caiçara (livro digital - PDF)
R$0,00
 Água no setor industrial da região do Alto Iguaçu e dos afluentes do Alto Ribeira... (Versão Digital - PDF)
R$0,00
Água no setor industrial da região do Alto Iguaçu e dos afluentes do Alto Ribeira... (Versão Digital - PDF)
R$0,00
O GIA é um grupo de pesquisas científicas, tecnológicas e de inovação criado e sediado na Universidade Federal do Paraná. Sua principal missão é assumir um papel direto na interação entre setor acadêmico, a iniciativa privada e a sociedade civil em geral, transpondo os muros universitários, aplicando com excelência e eficiência, métodos técnico-científicos de produção de alimentos e na resolução de problemas ambientais, sociais e econômicos que dizem respeito aos mais diferentes setores da sociedade brasileira.
No dia 09 de fevereiro de 2021 foi finalmente assinado o Termo de Compartilhamento estabelecido entre a UFPR, através de...
O GIA acaba de lançar mais um livro. O tema da vez é o cultivo de peixes orgânicos Cada vez...
Copyright © Grupo Integrado de Aquicultura e Estudos Ambientais (GIA) | Desenvolvido por Abrigo Virtual
Copyright © Grupo Integrado de Aquicultura e Estudos Ambientais (GIA) | Desenvolvido por Abrigo Virtual