Parceria GIA-ATGC
No dia 09 de fevereiro de 2021 foi finalmente assinado o Termo de Compartilhamento estabelecido entre a UFPR, através de...
Por Felipe Kacham de Carvalho e Diego Junqueira Stevanato
A ocorrência de parasitoses em peixes é limitante para o desenvolvimento da aquicultura em todo o mundo. Os peixes, de forma geral, são hospedeiros intermediários de inúmeros parasitos, organismos esses que expoliam o hospedeiro, podendo provocar altas taxas de mortalidade quando não tratadas a tempo. Entre os principais problemas encontrados hoje, a amiloodiniose precisa ser encarada com mais cautela, pois traz sérios riscos à saúde dos peixes.
Ela é uma doença causada pelo Amyloodinium ocellatum (NOGA e LEVY, 2006). Este protozoário é citado como um dos mais importantes parasitos em peixes, principalmente em regiões tropicais e subtropicais, sendo responsável por severas mortalidades em criações de peixes marinhos (RAMOS e OLIVERA, 2001; CRUZ-LACIERDA et. al., 2004; NOGA e LEVY, 2006). É provável, assim como visto no cenário mundial, que no Brasil, com o desenvolvimento da piscicultura marinha, inúmeras doenças e parasitoses se instalem nos sistemas de cultivo, tornando inevitável a presença da amiloodiniose.
O PARASITO
Amyloodinium ocellatum é um ectoparasito unicelular dinoflagelado de distribuição cosmopolita (Lom & Dyková 1992) é agente etiológico da amiloodiniose, que se localiza nas brânquias ou no tegumento (Pavanelli et al. 2008). Apresenta ciclo trifásico, incluindo o trofonte, estágio parasitário, que se fixa no tecido e se alimenta nas brânquias e tecido epitelial; o tomonte, estágio reprodutivo, que realiza divisões sobre o substrato e o estágio infeccioso, o dinosporo, que nada livremente na água ao encontro de um hospedeiro susceptível (Brown 1931, 1934, Nigrelli 1936, Brown & Hovasse 1946, Cheung et al. 1981). Este dinoflagelado termofílico e eurialino foi encontrado em inúmeras espécies de peixes selvagens estuarinas e marinhas (Sinderman, 1990; Southgate, 1993), sendo um dos poucos parasitas que podem infestar quer os elasmobrânquios (tubarões e raias) quer os teleósteos (Lawler, 1980). Em criação, a sua proliferação pode originar elevada mortalidade (Needham e Wootten, 1978).
O parasito atinge principalmente as brânquias (Brown, 1934; Brown e Hovasse, 1946; Sinderman, 1990; Noga, 1996) e também a pele (Lom e Dyková, 1992), esta distribuição pode se justificar pelo fato destes locais manterem constante contato com a água. Além disto, as brânquias são revestidas por um epitélio simples e altamente vascularizadas, propiciando boas condições para o desenvolvimento do trofonte. A ocorrência de epidemias deste dinoflagelado tem servido de base ao estudo morfológico do parasito, bem como do seu ciclo biológico (Brown, 1934; Brown e Hovasse 1946), a estudos ultra-estruturais das células branquiais infestadas e ao maior conhecimento sobre o efeito patogénico do parasito (Lom e Lawler, 1973 cit. Eiras, 1994).
A taxa reprodutiva é muito rápida, completando seu ciclo de vida em menos de uma semana em condições ótimas. É uma doença “silenciosa” porque geralmente quando o piscicultor descobre que o peixe está contaminado, já é tarde demais e eles não respondem ao tratamento. Dependendo da quantidade de peixes há um maior manejo que aumenta o estresse e desencadeia o surto.
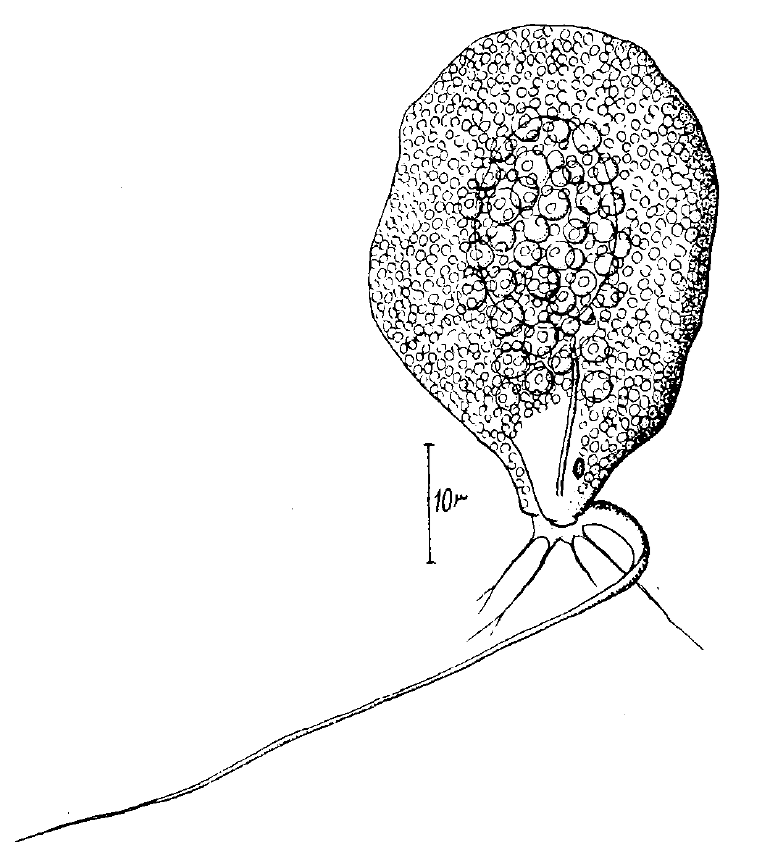
Figura 1. Amyloodinium ocellatum

Figura 2. Amyloodinium ocellatum fixados em branquias de tilápias.
DANOS NA AQUICULTURA
Na aquicultura o produtor deve atentar-se aos sinais clínicos iniciais, geralmente visíveis como as alterações comportamentais como perda de apetite, os peixes ficam se raspando contra objetos como paredes, fundos, canos ou qualquer outro substrato dos viveiros, aglomerados próximos aos aeradores e entradas de água, assim como na superfície da água, apresentado respiração rápida e natação errática.
Com a evolução do processo patológico, é possível observar manchas de despigmentação, congestão e erosão das nadadeiras, hipersecreção mucosa, perda de escamas e dilatação do ventre (Paperna 1980, Reed & Francis-Floyd 1994, Ramos & Oliveira 2001, Carvalho-Varela 2005).
Em casos mais severos, os peixes podem apresentar lesões, como hiperplasia das células do epitélio respiratório com fusão das lamelas seguidas de edema, levando ao descolamento das células do epitélio respiratório, alterações degenerativas, inflamação, hiperplasia acompanhada de hemorragia e necrose e depleção das células mucosas (Paperna 1980, Scott 2000, Ramos & Oliveira 2001, Pavanelli et al. 2008).
O A. ocellatum tolera uma ampla faixa de temperatura e salinidade, o que dificulta o controle dessa doença por meio da manipulação de parâmetros físicos e químicos. A inibição do crescimento do parasita pode ser alcançada em temperaturas abaixo de 15 ° C (Paperna, 1984) e salinidades reduzidas. Quando exposto a água doce, este parasito se desprende das brânquias e se abriga no sedimento (NOGA et al., 1991; OVERSTREET, 1993), o que poderia explicar uma inibição do A. ocellatum nos tratamentos de salinidade mais baixa e, consequentemente, as menores taxas de mortalidade registradas.
Em sistemas abertos, a prevenção só é possível através de uma monitorização rigorosa da presença do parasita nos peixes durante períodos ótimos de crescimento e evitando situações de stress nos peixes. Quando os peixes são submetidos ao estresse, o parasita pode aumentar rapidamente e causar mortalidades pesadas. Manejo adequado e procedimentos rotineiros de higiene, como a eliminação de peixes mortos de tanques e viveiros devem ser atenciosos e podem, sem dúvidas, prevenir a disseminação desse problema nos cultivos.
REFERENCIAS
Brown E.M. 1934. On Oodinium ocellatum Brown, a parasitic dinoflagellate causing epidemic disease in marine fish. Proc. Zool. Soc. Lon. 3:583-607.
Carvalho-Varela M. 2005. Parasitos e Parasitoses em Piscicultura. Ordem dos Médicos Veterinários, Lisboa, Portugal. 580p.
Lom J. & Dyková I. 1992. Flagellates (Phylum Mastigophora Diesing,1866), p.25-74. In: Ibid. (Eds), Protozoan Parasites of Fishes. Elsevier Science Publishers. Aquaculture and Fisheries Science v.26. Amsterdam, Netherlands.
Nigrelli R.F. 1936. The morphology, cytology, and life history of Oodinium ocellatum Brown, a dinoflagellate parasitic on marine fishes. Zoológica 21:129-164.
Tavares-Dias M. 2003. Variáveis hematológicas de teleósteos brasileiros de importância zootécnica. Tese de Doutorado em Aquicultura, Centro de Aquicultura, Universidade Estadual Paulista, Jaboticabal, SP. 209p.
Scott P. 2000. Terapéutica em acuicultura, p.137-160. In: Brown L. (Ed.), Acuicultura, para Veterinarios: producción y clínica de peces. Acribia, Zaragoza, Espanha.
Paperna I. 1980. Amyloodinium ocellatum (Brown, 1931) (Dinoflagellida) infestations in cultured marine fish at Eilat, Red Sea: epizootiology and pathology. J. Fish Dis. 3:363-372.
NOGA, E.J. e LEVY, M.G. 2006 Phylum Dinoflagellata. In: WOO, P.T.K. Fish Diseases and Disorders: Protozoan and Metazoan Infections. vol. 1, 2ª ed. CAB International, Wallingford. p.16-45.
NOGA, E.J.; SMITH, S.A.; LANDSBERG, J.H. 1991 Amyloodiniosis in cultured hybrid striped bass (Morone saxatilis x M. chrysops) in North Carolina. Journal of Aquatic Animal Health, 3: 294–297.
L AWLER, A. R., 1980. Studies on Amyloodinium ocellatum (Dinoflagellata) in Mississipi Sound: Natural and Experimental Hosts. Gulf Research Reports, 6 (4), 403-413.
NEEDHAM, F. & WOOTTEN, R., 1978. The Parasitology of Teleosts. In: Fish Pathology. Editor: Ronald J. Roberts. Baillière Tindall, London, U.K, 144-182.
Lom, J. & Lawler A. R., 1973 – An ultrastructural study on the mode of attachment in dinoflagellates invading gills of Cyprinodontidae. Protologica, 9:293-309.
 Recursos naturais na vida caiçara (livro digital - PDF)
R$0,00
Recursos naturais na vida caiçara (livro digital - PDF)
R$0,00
 Cartilha de Rastreabilidade: Ostras cultivadas - Projeto AquiNordeste (Livro Digital - PDF).
Cartilha de Rastreabilidade: Ostras cultivadas - Projeto AquiNordeste (Livro Digital - PDF).
 Manual de ostreicultura com espécies nativas da região Nordeste do Brasil (livro digital - PDF)
R$0,00
Manual de ostreicultura com espécies nativas da região Nordeste do Brasil (livro digital - PDF)
R$0,00
 Um pouco de tudo o que você sempre quis saber sobre o cultivo de peixes orgânicos (livro digital - PDF)
R$0,00
Um pouco de tudo o que você sempre quis saber sobre o cultivo de peixes orgânicos (livro digital - PDF)
R$0,00
 Rastreabilidade na ostreicultura: conceitos, fundamentos e casos... (livro digital - PDF)
R$0,00
Rastreabilidade na ostreicultura: conceitos, fundamentos e casos... (livro digital - PDF)
R$0,00
 Camarões Marinhos Reprodução, Maturação e Larvicultura (Livro Impresso)
R$50,00
Camarões Marinhos Reprodução, Maturação e Larvicultura (Livro Impresso)
R$50,00
 Atlas Anatômico e Histológico do Caranguejo-uçá (Livro Impresso)
Atlas Anatômico e Histológico do Caranguejo-uçá (Livro Impresso)
 FAO: Agricultura Irrigada Sustentável no Brasil - Identificação de Áreas... (Livro Digital - PDF)
R$0,00
FAO: Agricultura Irrigada Sustentável no Brasil - Identificação de Áreas... (Livro Digital - PDF)
R$0,00
 As lendas na educação - Estórias do Baixo Sul e do Recôncavo Baiano (livro digital - PDF)
R$0,00
As lendas na educação - Estórias do Baixo Sul e do Recôncavo Baiano (livro digital - PDF)
R$0,00
 Água na indústria: uma análise da visão do setor industrial... (Versão Digital - PDF)
R$0,00
Água na indústria: uma análise da visão do setor industrial... (Versão Digital - PDF)
R$0,00
O GIA é um grupo de pesquisas científicas, tecnológicas e de inovação criado e sediado na Universidade Federal do Paraná. Sua principal missão é assumir um papel direto na interação entre setor acadêmico, a iniciativa privada e a sociedade civil em geral, transpondo os muros universitários, aplicando com excelência e eficiência, métodos técnico-científicos de produção de alimentos e na resolução de problemas ambientais, sociais e econômicos que dizem respeito aos mais diferentes setores da sociedade brasileira.
No dia 09 de fevereiro de 2021 foi finalmente assinado o Termo de Compartilhamento estabelecido entre a UFPR, através de...
O GIA acaba de lançar mais um livro. O tema da vez é o cultivo de peixes orgânicos Cada vez...
Copyright © Grupo Integrado de Aquicultura e Estudos Ambientais (GIA) | Desenvolvido por Abrigo Virtual
Copyright © Grupo Integrado de Aquicultura e Estudos Ambientais (GIA) | Desenvolvido por Abrigo Virtual