Parceria GIA-ATGC
No dia 09 de fevereiro de 2021 foi finalmente assinado o Termo de Compartilhamento estabelecido entre a UFPR, através de...
Por: Thayzi O. Zeni
Publicado em: 10/03/2015
Os cromossomos são amplamente utilizados em estudos citogenéticos clássicos, sendo muito comum a observação e quantificação de aberrações durante as divisões celulares. Embora o uso da citogenética forneça resultados precisos, a complexidade do trabalho a ser realizado e a dificuldade causada pela presença de artefatos tem estimulado o surgimento de técnicas mais simples para identificar e quantificar danos cromossômicos (Fenech, 2000). Dentre os métodos alternativos mais comumente utilizados, estão os micronúcleos e os ensaios cometa (van der Oost et al., 2003)
Teste de micronúcleo
Micronúcleo é uma massa de cromatina originada de fragmentos cromossômicos ou de cromossomos inteiros, que se perderam durante a divisão celular, devido aos eventos clastogênicos (quebra de cromossomos) ou aneugênicos (que induzem a aneuploidia ou a segregação cromossômica anormal) (Figura 1). Este método possui a capacidade de detectar a quebra de cromossomos e também a segregação cromossômica anormal (Ribeiro et al., 2003). Baseia-se no fato de que a formação espontânea de micronúcleos é baixa e quase uniforme entre as espécies. Desta forma, efeitos de substâncias que provoquem as quebras cromossômicas ou ainda afetem componentes do fuso ou da região centromérica, podem ser detectados a partir da presença de micronúcleos (Heddle et al.,1991).
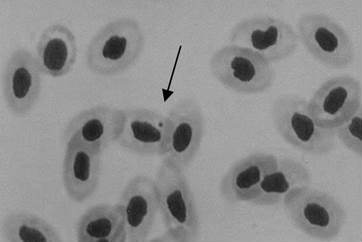
Figura 1. Micronúcleo em eritrócito (seta) de sangue periférico de Tilapia rendall. Coloração de Giemsa 5% (Fonte: Rivero, 2007).
A desvantagem deste método está no fato de o teste só poder ser utilizado em células eucarióticas em divisão, não apresentando bons resultados em populações de células que não estejam em divisão ou nas quais as características da divisão celular não sejam bem conhecidas (Fenech, 2000). As vantagens do uso desse método, entretanto, são inúmeras. Carvalho et al. (2002) apontaram a possibilidade de avaliação de um grande número de amostras de maneira relativamente rápida e o fato deste não ser invasivo, permitindo identificar aumento na frequência de mutações em células expostas à inúmeros agentes genotóxicos. Esse método também é considerado simples, confiável, sensível e de baixo custo (Russo et al., 2004), o que possibilita rápida detecção de impactos genotóxicos nos organismos.
Além das características mencionadas, o teste de micronúcleo pode ser utilizado em qualquer tipo de população celular em proliferação, sem que haja necessidade de conhecimento prévio do cariótipo do animal avaliado (Hayashi et al., 1998). Por estes motivos, esta técnica é indicada para triagens de rotina e monitoramentos ambientais (Siu et al., 2003), permitindo assim a avaliação dos impactos biológicos em ambientes aquáticos poluídos.
Devido ao fato de peixes apresentarem cromossomos de tamanho reduzido e geralmente em grande quantidade, as pesquisas de aberrações cromossômicas durante a metáfase tornam-se difíceis (Hayashi et al., 1998). As análises de micronúcleo, entretanto, são relativamente simples de serem realizadas, uma vez que peixes possuem eritrócitos nucleados (Hayashi et al., op. cit.).
O ensaio cometa
O ensaio cometa, ou eletroforese em gel de célula única, é um método utilizado na pesquisa de lesões genômicas, que evoluem para mutações quando não corrigidas (Gontijo e Tice, 2003). Este método pode ser realizado em qualquer célula nucleada eucariótica (Mitchelmore e Chipman, 1998) e apresenta como vantagens a alta sensibilidade para a detecção de danos no DNA, a possibilidade de uso de um número reduzido de células, a facilidade de execução e o custo acessível (Tice et al., 2000). Além de apresentar boa produtividade e ser aplicável em qualquer organismo eucarioto (Castro, 2004).
O ensaio cometa é uma ferramenta fundamental de investigação em estudos de reparo de DNA, biomonitoramento ambiental e teste de genotoxicidade (Ross et al., 1995).
A técnica do cometa se baseia na detecção de fragmentos de DNA que, após indução por eletroforese, migram a partir do centro nuclear com uma velocidade superior a do DNA intacto, formando uma estrutura com aspecto de cauda de cometa (Tice et al.,1990) (Figura 2).
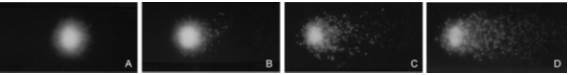
Figura 2. Resultado obtido após a exposição de Oreochromis niloticus ao cromo. A. Classe 0 (célula sem danos); B. Classe1 (célula com pequenos danos); C. Classe 2 (danos médios) e D. Classe 3 (muitos danos). Fonte: Matsumoto et al., 2006.
A principal vantagem do ensaio de cometa é sua alta sensibilidade a inúmeros tipos de danos de DNA (Bucker et al., 2006), sendo considerado em alguns casos, mais sensível à ação de agentes genotóxicos do que o teste de micronúcleo (Matsumoto et al., 2006).
Por conseguinte, pode-se inferir que tanto o teste de micronúcleo, quanto ensaio cometa são bons marcadores biológicos para a avaliação de genotoxicidade, sendo possível sua utilização em laboratório e/ou a campo.
Referências
CARVALHO, M. B. RAMIREZ, A., GATTÁS, G. J. F., GUEDES, A. L., AMAR, A., RAPOPORT, A., NETO, J. C. B., CURIONI, O. A., 2002. Correlação entre a evolução clínica e a frequência de micronúcleos em células de pacientes portadores de carcinomas orais e da orofaringe. Revista da Associação Médica Brasileira, 48 (4): 317-322
CASTRO, V. L., 2004.Aspectos da exposição ambiental aos agroquímicos no desenvolvimento animal. Cadernos de Ciências e Tecnologia, 21: 469-497
FENECH, M. The in vitro micronucleus technique, 2000. Mutation Research 455: 81–95
GONTIJO, A. M. M. C., TICE, R., 2003. Teste do cometa para a detecção de dano no DNA e reparo em células individualizadas. In: RIBEIRO, L. R.; SALVADORI, D. M. F., MARQUES, E. K.(Org.). Mutagênese Ambiental. Canoas: Ulbrap. 173-200
HAYASHI M, UEDA T, UYENO K, WADA K, KINAE N, SAOTOME K, TANAKA N. TAKAI A, SASAKI YF, ASANO N, SOFUNI T e OJIMA Y., 1998.Development of genotoxicity assays systems that use aquatic organisms. Mutation Research, 399 (2): 125-133
HEDDLE, J. A. et al. 1991. Micronuclei as a index of cytogenetic damage: past, present and future. Environment Molecular Mutagenicity, 18: 277-291
MITCHELMORE, C. L., CHIPMAN, J. K., 1998. DNA strand breakage in aquatic organisms and the potential value of the comet assay in environmental monitoring. Mutation Research, 399: 135-147
RIBEIRO, L.R.; SALVADOR, D.M.F.; MARQUES, E.K. Mutagênese Ambiental. Editora Ulbra. Canoas: 1o ed., 2003
RIVERO, C. L. G., 2007. Perfil da frequência de micronúcleos e de danos no DNA de diferentes espécies de peixes do Lago Paranoá, Brasília, DF, Brasil. Dissertação apresentada a pós graduação em patologia molecular da Universidade Nacional de Brasília
ROSS, G. M., McMILLAN, T. J., WILCOX, P., COLLINS, A. R., 1995. The Single Cell Gel Electrophoresis Assay (comet assay): Technical Aspects and Applications. Report on the 5 thLH Gray Trust Workshop, Institute of Cancer Research. Mutation Research, 337: 57-60
RUSSO, C., ROCCO, L., MORESCALCHI, M. A., STINGO, V., 2004. Assessment of environmental stress by the Micronucleus test and the Comet assay on the genome of teleost populations from two natural environments. Ecotoxicology and Environmental Safety 57: 168-174
SIU, W.H.L., CAO, J., JACK, R.W., WU, R.S.S., RICHARDSON, B.J., XU, L.,LAM, P.K.S., 2004. Application of the comet and micronucleus assays to the detection of B(A) P genotoxicity in haemocytes of the green-lipped mussel (Perna viridis). Aquatic Toxicology, 66: 381-392
TICE, R. R., AGURELL, E., ANDERSON, D., BURLINSON, B., HARTMANN, A., KOBAYASHI, H., MIYAMAE, Y., ROJAS, E., RYU, J. C., SASAKI, Y. F. , 2000. Single Cell gel/comet assay: guidelines for in vitro and in vivo genetic toxicology testing. Environmental and Molecular Mutagenesis, 35: 206-22
VAN DER OOST, R., BEYER, J., VERMEULEN, N. P. E., 2003. Fish bioaccumulation and biomarkers in environmental risk assessment: a review. Environmental Toxicology and Pharmacology, 13: 57-149
 FAO: Agricultura Irrigada Sustentável no Brasil - Identificação de Áreas... (Livro Digital - PDF)
R$0,00
FAO: Agricultura Irrigada Sustentável no Brasil - Identificação de Áreas... (Livro Digital - PDF)
R$0,00
 A produção integrada na carcinicultura brasileira (Volume 1) - (Livro Digital - PDF)
R$0,00
A produção integrada na carcinicultura brasileira (Volume 1) - (Livro Digital - PDF)
R$0,00
 Camarões Marinhos Reprodução, Maturação e Larvicultura (Livro Impresso)
R$50,00
Camarões Marinhos Reprodução, Maturação e Larvicultura (Livro Impresso)
R$50,00
 Camarões Marinhos - Engorda: Roberto Carlos Barbieri Jr. & Antonio Ostrensky (Livro Impresso)
R$55,00
Camarões Marinhos - Engorda: Roberto Carlos Barbieri Jr. & Antonio Ostrensky (Livro Impresso)
R$55,00
 Fichas Técnicas Ilustradas - Sebrae/Projeto AquiNordeste (Livro Digital - PDF)
R$0,00
Fichas Técnicas Ilustradas - Sebrae/Projeto AquiNordeste (Livro Digital - PDF)
R$0,00
 Água na indústria: uma análise da visão do setor industrial... (Versão Digital - PDF)
R$0,00
Água na indústria: uma análise da visão do setor industrial... (Versão Digital - PDF)
R$0,00
 As lendas na educação - Estórias do Baixo Sul e do Recôncavo Baiano (livro digital - PDF)
R$0,00
As lendas na educação - Estórias do Baixo Sul e do Recôncavo Baiano (livro digital - PDF)
R$0,00
 Um pouco de tudo o que você sempre quis saber sobre o cultivo de peixes orgânicos (livro digital - PDF)
R$0,00
Um pouco de tudo o que você sempre quis saber sobre o cultivo de peixes orgânicos (livro digital - PDF)
R$0,00
 Água no setor industrial da região do Alto Iguaçu e dos afluentes do Alto Ribeira... (Versão Digital - PDF)
R$0,00
Água no setor industrial da região do Alto Iguaçu e dos afluentes do Alto Ribeira... (Versão Digital - PDF)
R$0,00
 Manual de ostreicultura com espécies nativas da região Nordeste do Brasil (livro digital - PDF)
R$0,00
Manual de ostreicultura com espécies nativas da região Nordeste do Brasil (livro digital - PDF)
R$0,00
O GIA é um grupo de pesquisas científicas, tecnológicas e de inovação criado e sediado na Universidade Federal do Paraná. Sua principal missão é assumir um papel direto na interação entre setor acadêmico, a iniciativa privada e a sociedade civil em geral, transpondo os muros universitários, aplicando com excelência e eficiência, métodos técnico-científicos de produção de alimentos e na resolução de problemas ambientais, sociais e econômicos que dizem respeito aos mais diferentes setores da sociedade brasileira.
No dia 09 de fevereiro de 2021 foi finalmente assinado o Termo de Compartilhamento estabelecido entre a UFPR, através de...
O GIA acaba de lançar mais um livro. O tema da vez é o cultivo de peixes orgânicos Cada vez...
Copyright © Grupo Integrado de Aquicultura e Estudos Ambientais (GIA) | Desenvolvido por Abrigo Virtual
Copyright © Grupo Integrado de Aquicultura e Estudos Ambientais (GIA) | Desenvolvido por Abrigo Virtual