Parceria GIA-ATGC
No dia 09 de fevereiro de 2021 foi finalmente assinado o Termo de Compartilhamento estabelecido entre a UFPR, através de...
Por Ana Paula Silva Bertão
Interação da radiação ultravioleta em ambientes límnicos
A exposição aos raios da radiação ultravioleta – UVR, podem atingir a superfície da terra em comprimentos de onda entre 290 a 400nm. A radiação ultravioleta é dividida nas seguintes bandas: UVA onda longa (315–400 nm), UVB onda média (280–315 nm) e UVC onda curta (100–280 nm). Praticamente 99,9 % do UVC e 95% da radiação UVB são absorvidos pela camada protetora de ozônio na estratosfera. A intensidade da radiação UV incidente na superfície terrestre é influenciada por vários fatores, como, estação do ano, hora do dia, a cobertura de nuvens, latitude e altitude, reflexão dos raios na superfície e ozônio estratosférico (McKenzie et al. 2008; Sousa 2013).
Os habitats aquáticos diferem enormemente em sua transparência, algumas substâncias absorventes e dispersantes atenuam a radiação incidente, especialmente em habitats eutrófico de água doce (Callaghan et al. 2004). O material particulado inorgânico, carbono orgânico dissolvido – DOC e carbono orgânico particulado – POC, bem como uma variedade de substâncias húmicas, atenua significativamente a radiação de comprimento de onda curto (Harris et al. 2008). O DOC é bastante resistente à degradação na coluna d’água, mas é facilmente decomposto em subunidades menores pelo UV solar, que pode ser facilmente absorvido pelo bacterioplâncton (Wrona et al. 2006). Como consequência, esse processo diminui a atenuação na coluna d’água, resultando em uma penetração mais profunda da radiação solar (Shindell et al. 1998).
Para entender como a transparência da água interfere na absorção dos raios UV, podemos avaliar a profundidade que estes raios estão alcançando com o uso do disco de Secchi (Esteves 1998). Quanto maior a transparência da água, menor dispersão do campo da luz e maior a medida de profundidade do disco de Secchi. O valor do disco de Secchi é inversamente proporcional à quantidade de compostos orgânicos e inorgânicos no percurso da luz e ao coeficiente de atenuação da irradiância. O desaparecimento do disco de Secchi corresponde à profundidade na qual a radiação da faixa do visível não é mais sensível ao olho humano. A zona fótica pode ser estimada através da transparência do disco de Secchi (Esteves 1998). O desaparecimento do disco de Secchi corresponde a 10% da radiação superficial. O limite inferior da zona eufótica recebe apenas 1% da irradiância daquela recebida na superfície e, abaixo dessa é denominada de zona afótica (Fill and Santos 2001).
Efeito da radiação ultravioleta no eDNA
Os efeitos da radiação UV nos ambientes aquáticos podem variar muito em um mesmo ecossistema, devido a profundidade da água, luminosidade, claridade e quantidade de sólidos suspensos. O dano fotobiológico, causado pelos raios UV, pode incluir efeitos diretos da radiação UV, na qual os fótons são absorvidos por moléculas biológicas, como ácidos nucléicos e proteínas, que sofrem alterações fotoquímicas (Wrona et al. 2006).
O DNA é um dos principais alvos dos danos induzidos por UV em uma variedade de organismos aquáticos, como também de DNA ambiental presente no ecossistema. A radiação UV induz duas das lesões de DNA mutagênicas e citotóxicas mais abundantes, como os dímeros de ciclobutano pirimidina (CPDs) e fotoprodutos de pirimidina pirimidona (6-4PPs) e seus isômeros de valência Dewar (Wrona et al. 2006) (Figura 1). Em especial a UV-B, danifica o DNA ao enrolar e distorcer sua estrutura em forma de escada, causando degradação da fita (Wrona et al. 2006).
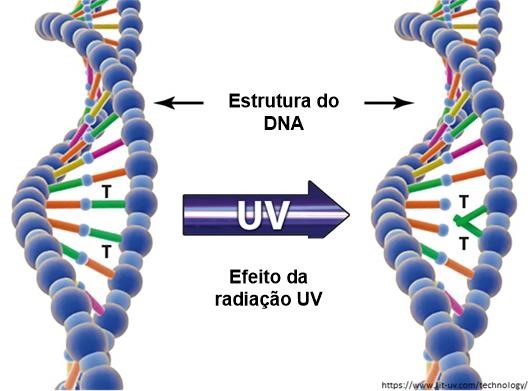
Diversos estudos avaliaram a taxa de degradação do eDNA em diferentes organismos. Estes estudos analisaram as principais características ambientais que podem influenciar na degradação do eDNA, entre elas estão como exemplo, a temperatura (Barnes et al. 2014), turbidez da água (Deiner et al. 2017; Stoeckle et al. 2017), acidez (Strickler et al. 2015) e a comunidade bacteriana (Lance et al. 2017)
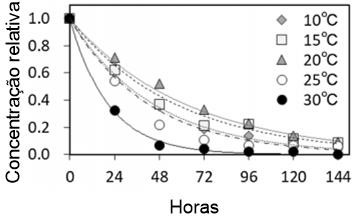
No estudo de Kasai et al. (2020) com enguias japonesas Anguilla japonica, os resultados mostram que mais da metade da deterioração do eDNA acontece no período de 48 horas, e o decaimento é mais evidente quando a temperatura estava em 30ºC (Figura 2).
No estudo de Eichmiller et al. (2016) com Cyprinus carpio, foi avaliado o efeito da temperatura na degradação do eDNA. O decaimento do DNA da carpa foi exponencial, essa queda foi evidenciada com aumento da temperatura. A menor taxa de decaimento foi observada a 5° C, com um valor de T90 (tempo para redução de 90% da concentração inicial). Diferentemente das temperaturas de 20 a 35º C, onde a degradação foi muito maior.
Importância do estudo da degradação do eDNA
O uso preciso e biologicamente relevante do eDNA como avaliação da presença, abundância e localização dos organismos-alvo requer uma compreensão das taxas de decaimento do eDNA (a redução na quantidade detectável de eDNA) e degradação (alterações físicas na molécula / partícula) em diferentes ambientes (Harrison et al. 2019).
Os processos que podem contribuir para a remoção ou degradação do eDNA em sistemas aquáticos, inicia por uma via primária de decaimento do eDNA, que é a degradação física do tecido e das partículas que compreendem o eDNA. O tecido biológico derramado geralmente começa a se degradar imediatamente de fragmentos de tecido multicelular, para células inteiras, organelas separadas (por exemplo, mitocôndrias) e, eventualmente, para liberar DNA (extracelular), que por sua vez são intensificados são e degradados por enzimas exógenas ou por reações químicas espontâneas (Turner et al. 2014).
Informações sobre degradação do eDNA referentes a temperatura, radiação ultravioleta e comunidade bacteriana devem ser considerados e aplicados em protocolos de armazenamento de amostras de água e em projeto de amostragem de campo para que venham diminuir a degradação de DNA em amostras ambientais (Eichmiller et al. 2016; Harrison et al. 2019).
Bibliografia
Barnes MA, Turner CR, Jerde CL, Renshaw MA, Chadderton WL, Lodge DM (2014) Environmental conditions influence eDNA persistence in aquatic systems Environmental science & technology 48:1819-1827
Callaghan TV et al. (2004) Effects of changes in climate on landscape and regional processes, and feedbacks to the climate system AMBIO: A Journal of the Human Environment 33:459-468
Deiner K et al. (2017) Environmental DNA metabarcoding: Transforming how we survey animal and plant communities Molecular ecology 26:5872-5895
Eichmiller JJ, Best SaE, Sorensen PW (2016) Effects of temperature and trophic state on degradation of environmental DNA in lake water Environmental science & technology 50:1859-1867
Esteves FA (1998) Fundamentos de limnologia. Interciência,
Fill HD, Santos Id (2001) Estimativa da concentração de sedimentos em suspensão através da profundidade Secchi V Simpósio de Hidráulica e Recursos Hídricos dos Países de Língua Oficial Portuguesa
Harris NR et al. Ozone trends at northern mid-and high latitudes: a European perspective. In: Annales Geophysicae, 2008. vol 5. European Geosciences Union, pp 1207-1220
Harrison JB, Sunday JM, Rogers SM (2019) Predicting the fate of eDNA in the environment and implications for studying biodiversity Proceedings of the Royal Society B 286:20191409
Kasai A, Takada S, Yamazaki A, Masuda R, Yamanaka H (2020) The effect of temperature on environmental DNA degradation of Japanese eel Fisheries Science:1-7
Lance RF et al. (2017) Experimental observations on the decay of environmental DNA from bighead and silver carps Management of Biological Invasions 8:343
McKenzie R et al. (2008) Effects of urban pollution on UV spectral irradiances
Shindell DT, Rind D, Lonergan P (1998) Increased polar stratospheric ozone losses and delayed eventual recovery owing to increasing greenhouse-gas concentrations Nature 392:589-592
Sousa SA (2013) A radiação ultravioleta nos ecossistemas aquáticos e seus impactos nas diferentes espécies: uma revisão bibliográfica
Stoeckle BC, Beggel S, Cerwenka AF, Motivans E, Kuehn R, Geist J (2017) A systematic approach to evaluate the influence of environmental conditions on eDNA detection success in aquatic ecosystems PloS one 12:e0189119
Strickler KM, Fremier AK, Goldberg CS (2015) Quantifying effects of UV-B, temperature, and pH on eDNA degradation in aquatic microcosms Biological Conservation 183:85-92
Turner CR, Barnes MA, Xu CC, Jones SE, Jerde CL, Lodge DM (2014) Particle size distribution and optimal capture of aqueous macrobial eDNA Methods in Ecology and Evolution 5:676-684
Wrona FJ, Prowse TD, Reist JD, Hobbie JE, Lévesque LM, Macdonald RW, Vincent WF (2006) Effects of ultraviolet radiation and contaminant-related stressors on Arctic freshwater ecosystems AMBIO: A Journal of the Human Environment 35:388-401
 FAO: Agricultura Irrigada Sustentável no Brasil - Identificação de Áreas... (Livro Digital - PDF)
R$0,00
FAO: Agricultura Irrigada Sustentável no Brasil - Identificação de Áreas... (Livro Digital - PDF)
R$0,00
 Manual de Boas Práticas: Qualidade e Segurança para Bons Negócios (livro digital - PDF)
R$0,00
Manual de Boas Práticas: Qualidade e Segurança para Bons Negócios (livro digital - PDF)
R$0,00
 Camarões Marinhos - Engorda: Roberto Carlos Barbieri Jr. & Antonio Ostrensky (Livro Impresso)
R$55,00
Camarões Marinhos - Engorda: Roberto Carlos Barbieri Jr. & Antonio Ostrensky (Livro Impresso)
R$55,00
 Um pouco de tudo o que você sempre quis saber sobre o cultivo de peixes orgânicos (livro digital - PDF)
R$0,00
Um pouco de tudo o que você sempre quis saber sobre o cultivo de peixes orgânicos (livro digital - PDF)
R$0,00
 Cartilha de Rastreabilidade: Ostras cultivadas - Projeto AquiNordeste (Livro Digital - PDF).
Cartilha de Rastreabilidade: Ostras cultivadas - Projeto AquiNordeste (Livro Digital - PDF).
 Recursos naturais na vida caiçara (livro digital - PDF)
R$0,00
Recursos naturais na vida caiçara (livro digital - PDF)
R$0,00
 Fichas Técnicas Ilustradas - Sebrae/Projeto AquiNordeste (Livro Digital - PDF)
R$0,00
Fichas Técnicas Ilustradas - Sebrae/Projeto AquiNordeste (Livro Digital - PDF)
R$0,00
 As lendas na educação - Estórias do Baixo Sul e do Recôncavo Baiano (livro digital - PDF)
R$0,00
As lendas na educação - Estórias do Baixo Sul e do Recôncavo Baiano (livro digital - PDF)
R$0,00
 A produção integrada na carcinicultura brasileira (Volume 2) - (Livro Digital - PDF)
R$0,00
A produção integrada na carcinicultura brasileira (Volume 2) - (Livro Digital - PDF)
R$0,00
 Manual de ostreicultura com espécies nativas da região Nordeste do Brasil (livro digital - PDF)
R$0,00
Manual de ostreicultura com espécies nativas da região Nordeste do Brasil (livro digital - PDF)
R$0,00
O GIA é um grupo de pesquisas científicas, tecnológicas e de inovação criado e sediado na Universidade Federal do Paraná. Sua principal missão é assumir um papel direto na interação entre setor acadêmico, a iniciativa privada e a sociedade civil em geral, transpondo os muros universitários, aplicando com excelência e eficiência, métodos técnico-científicos de produção de alimentos e na resolução de problemas ambientais, sociais e econômicos que dizem respeito aos mais diferentes setores da sociedade brasileira.
No dia 09 de fevereiro de 2021 foi finalmente assinado o Termo de Compartilhamento estabelecido entre a UFPR, através de...
O GIA acaba de lançar mais um livro. O tema da vez é o cultivo de peixes orgânicos Cada vez...
Copyright © Grupo Integrado de Aquicultura e Estudos Ambientais (GIA) | Desenvolvido por Abrigo Virtual
Copyright © Grupo Integrado de Aquicultura e Estudos Ambientais (GIA) | Desenvolvido por Abrigo Virtual